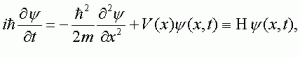El filósofo hilário y su cuchillo (III)
Recordaréis que Thomson había complicado mucho el problema de la materia al descubrir el electrón. El átomo químico, del que se creía que era la partícula indivisible planteada por Demócrito, tenía ahora cositas que revoloteaban en su interior. La carga de estos electrones era negativa, lo que suponía un problema. La materia es neutral, ni positiva ni negativa. Así que ¿qué compensa a los electrones?
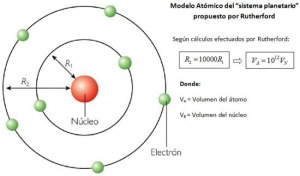 En mayo de 1911 se publicó el artículo donde Rutherford declaraba la existencia del núcleo atómico. Fue el final de una era. Ahora se veía, correctamente, que el átomo era complejo, no simple, y divisible, en absoluto a-tómico. Fue el principio de una era nueva, la era de la física nuclear, y supuso la muerte de la física clásica, al menos dentro del átomo.
En mayo de 1911 se publicó el artículo donde Rutherford declaraba la existencia del núcleo atómico. Fue el final de una era. Ahora se veía, correctamente, que el átomo era complejo, no simple, y divisible, en absoluto a-tómico. Fue el principio de una era nueva, la era de la física nuclear, y supuso la muerte de la física clásica, al menos dentro del átomo.
Con el tiempo y datos mejores, la teoría de Rutherford se refinó. La carga central positiva (el núcleo) ocupa un volumen de no más de una billonésima parte del volumen del átomo. Según el modelo de Rutherford, la materia es, más que nada, espacio vacío. Cuando tocamos una mesa, la percibimos sólida, pero es el juego entre las fuerzas eléctricas (y las reglas cuánticas) de los átomos y moléculas lo que crea la ilusión de solidez. El átomo está  casi vacío. Aristóteles se habría quedado de piedra.
casi vacío. Aristóteles se habría quedado de piedra.
El modelo de Rutherford fue un auténtico hito. Se trataba en muy buena medida de un sistema solar en miniatura: un núcleo central cargado positivamente con cierto número de electrones en varias órbitas de forma que la carga total negativa cancelase la carga nuclear positiva. Se recurría cuando convenía a Maxwell y Newton. El electrón orbital, como los planetas, obedecía el mandato de Newton, F = ma. F era en este caso la fuerza eléctrica (la ley de Coulomb) entre las partículas cargadas. Como se trata, al igual que la gravedad, de una fuerza del inverso del cuadrado, cabría suponer a primera vista que de ahí se seguirían órbitas planetarias, estables. Ahí lo tenéis, el hermoso y diáfano modelo del átomo como un sistema solar. Todo iba bien.
 Bueno, todo iba bien hasta que llegó a Manchester un joven físico danés, de inclinación teórica. «Mi nombre es Bohr, Niels Henrik David Bohr, profesor Rutherford. Soy un joven físico teórico y estoy aquí para ayudarle.» Os podréis imaginar la reacción del rudo neozelandés, que no se andaba por las ramas.
Bueno, todo iba bien hasta que llegó a Manchester un joven físico danés, de inclinación teórica. «Mi nombre es Bohr, Niels Henrik David Bohr, profesor Rutherford. Soy un joven físico teórico y estoy aquí para ayudarle.» Os podréis imaginar la reacción del rudo neozelandés, que no se andaba por las ramas.
La revolución en marcha que se conoce por el nombre de teoría cuántica no nació ya crecida del todo en las cabezas de los teóricos. Fue gestándose poco a poco a partir de los datos que generaba el átomo químico. Cabe considerar el esfuerzo por comprender este átomo como un ensayo de la verdadera lucha, la del conocimiento del subátomo, de la jungla subnuclear.
El descubrimiento de Rutherford, que vino tras varios resultados experimentales que contradecían la física clásica, fue el último clavo del ataúd. En la pugna en marcha entre el experimento y la teoría, habría sido una buena oportunidad para insistir una vez más: «¿Hasta qué punto tendremos que dejar las cosas claras los experimentadores antes de que los teóricos os convenzáis de que os hace falta algo nuevo?». Parece que Rutherford no se dio cuenta de cuánta desolación iba a sembrar su nuevo átomo en la física clásica.
Y en éstas aparece Bohr.
 Bohr vio la verdadera importancia del nuevo modelo. Sabía que los electrones que describían órbitas circulares alrededor de un núcleo central tenían que radiar, según las leyes de Maxwell, energía, como un electrón que se acelera arriba y abajo por una antena. Para que se satisfagan las leyes de conservación de la energía, las órbitas deben contraerse y el electrón, en un abrir y cerrar de ojos, caerá en espiral hacia el núcleo. Si se cumpliesen todas esas condiciones, la materia sería inestable. ¡El modelo era un desastre clásico! Sin embargo, no había en realidad otra posibilidad.
Bohr vio la verdadera importancia del nuevo modelo. Sabía que los electrones que describían órbitas circulares alrededor de un núcleo central tenían que radiar, según las leyes de Maxwell, energía, como un electrón que se acelera arriba y abajo por una antena. Para que se satisfagan las leyes de conservación de la energía, las órbitas deben contraerse y el electrón, en un abrir y cerrar de ojos, caerá en espiral hacia el núcleo. Si se cumpliesen todas esas condiciones, la materia sería inestable. ¡El modelo era un desastre clásico! Sin embargo, no había en realidad otra posibilidad.
A Bohr no le quedaba otra salida que intentar algo que fuera muy nuevo.
Observó que no hay nada en la física clásica que determine el radio de la órbita del electrón en el átomo de hidrógeno. En realidad, el sistema solar es un buen ejemplo de una variedad de órbitas planetarias. Según las leyes de Newton, se puede imaginar cualquier órbita planetaria; basta con que se arranque de la forma apropiada. Una vez se fija un radio, la velocidad del planeta en la órbita y su periodo (el año) quedan determinados. Pero parecía que todos los átomos de hidrógeno son exactamente iguales. Los átomos no muestran en absoluto la variedad que exhibe el sistema solar. Bohr hizo la afirmación, sensata pero absolutamente anticlásica, de que sólo ciertas órbitas estaban permitidas.
Bohr propuso, además, que en esas órbitas especiales el electrón no radia. En el contexto histórico, esta hipótesis fue increíblemente audaz. Maxwell se revolvió en su tumba, pero Bohr sólo intentaba dar un sentido a los hechos.
 Le dio al único electrón del átomo de hidrógeno un conjunto de radios permitidos que representaban un conjunto de estados de energía cada vez mayor. Para explicar las líneas espectrales se sacó de la manga que la radiación se produce cuando un electrón «salta» de un nivel de energía a otro inferior; la energía del fotón radiado es la diferencia entre los dos niveles de energía. Propuso entonces un verdadero delirio de regla para esos radios especiales que determinan los niveles de energía. Sólo se permiten, dijo, las órbitas en las que el momento orbital, magnitud de uso corriente que mide el impulso rotacional del electrón, tome, medido en una nueva unidad cuántica, un valor entero. La unidad cuántica de Bohr no era sino la constante de Planck, h.
Le dio al único electrón del átomo de hidrógeno un conjunto de radios permitidos que representaban un conjunto de estados de energía cada vez mayor. Para explicar las líneas espectrales se sacó de la manga que la radiación se produce cuando un electrón «salta» de un nivel de energía a otro inferior; la energía del fotón radiado es la diferencia entre los dos niveles de energía. Propuso entonces un verdadero delirio de regla para esos radios especiales que determinan los niveles de energía. Sólo se permiten, dijo, las órbitas en las que el momento orbital, magnitud de uso corriente que mide el impulso rotacional del electrón, tome, medido en una nueva unidad cuántica, un valor entero. La unidad cuántica de Bohr no era sino la constante de Planck, h.
La teoría de Bohr se confeccionó de forma que diese los números del hidrógeno que salen en los libros. En sus análisis fue decisivo el dominante concepto de energía, palabra que se definió con precisión en los tiempos de Newton, y que luego había ido evolucionando y creciendo. La energía es interesante sólo porque se conserva.
La explicación del átomo ad hoc, cuasiclásica de Bohr, fue una obra, aunque heterodoxa, de virtuoso. Echó mano de Newton y Maxwell cuando convenía. Los descartó cuando no. Recurrió a Planck y Einstein allí donde funcionaban. Algo monstruoso. Pero Bohr era brillante y obtuvo la solución correcta.
 A la teoría de Bohr, desarrollada entre 1913 y 1925, se le da el nombre de «vieja teoría cuántica». Planck, Einstein y Bohr habían ido haciendo caso omiso de la mecánica clásica en uno u otro aspecto. Todos tenían datos experimentales sólidos que les decían que tenían razón. La teoría de Planck concordaba espléndidamente con el espectro del cuerpo negro, la de Einstein con las mediciones detalladas de los fotoelectrones. En la fórmula matemática de Bohr aparecen la carga y la masa del electrón, la constante de Planck, unos cuantos π, números (el 3) y un entero importante (el número cuántico) que numera los estados de energía. Todas estas magnitudes, multiplicadas y divididas oportunamente, dan una fórmula con la que se pueden calcular todas las líneas espectrales del hidrógeno. Su acuerdo con los datos era notable.
A la teoría de Bohr, desarrollada entre 1913 y 1925, se le da el nombre de «vieja teoría cuántica». Planck, Einstein y Bohr habían ido haciendo caso omiso de la mecánica clásica en uno u otro aspecto. Todos tenían datos experimentales sólidos que les decían que tenían razón. La teoría de Planck concordaba espléndidamente con el espectro del cuerpo negro, la de Einstein con las mediciones detalladas de los fotoelectrones. En la fórmula matemática de Bohr aparecen la carga y la masa del electrón, la constante de Planck, unos cuantos π, números (el 3) y un entero importante (el número cuántico) que numera los estados de energía. Todas estas magnitudes, multiplicadas y divididas oportunamente, dan una fórmula con la que se pueden calcular todas las líneas espectrales del hidrógeno. Su acuerdo con los datos era notable.
 Cuando el físico estadounidense Albert Michelson, un fanático de la precisión, examinó con mayor atención las líneas espectrales, observó que cada una de las líneas espectrales del hidrógeno consistía en realidad en dos líneas muy juntas, dos longitudes de onda muy parecidas. Esta duplicación de las líneas significaba que cuando el electrón va a saltar a un nivel inferior puede optar por dos estados de energía más bajos. El modelo de Bohr no predecía ese desdoblamiento, al que se llamó «estructura fina». Arnold Sommerfeld, contemporáneo y colaborador de Bohr, percibió que la velocidad de los electrones en el átomo de hidrógeno es una fracción considerable de la velocidad de la luz, así que había que tratarlos conforme a la teoría de la relatividad de Einstein de 1905; dio así el primer paso hacia la unión de las dos revoluciones, la teoría cuántica y la teoría de la relatividad. Cuando incluyó los efectos de la relatividad, vio que donde la teoría de Bohr predecía una órbita, la nueva teoría predecía dos muy próximas. Esto explicaba el desdoblamiento de las líneas. Al efectuar sus cálculos, Sommerfeld introdujo una «nueva abreviatura» de algunas constantes que aparecían con frecuencia en sus ecuaciones. Se trataba de 2πe² / hc, que abrevió con la letra griega alfa (α). No os preocupéis de la ecuación. Lo interesante es esto: cuando se meten los números conocidos de la carga del electrón, e, la constante de Planck, h, y la velocidad de la luz, c, sale α = 1/137. El 137, número puro.
Cuando el físico estadounidense Albert Michelson, un fanático de la precisión, examinó con mayor atención las líneas espectrales, observó que cada una de las líneas espectrales del hidrógeno consistía en realidad en dos líneas muy juntas, dos longitudes de onda muy parecidas. Esta duplicación de las líneas significaba que cuando el electrón va a saltar a un nivel inferior puede optar por dos estados de energía más bajos. El modelo de Bohr no predecía ese desdoblamiento, al que se llamó «estructura fina». Arnold Sommerfeld, contemporáneo y colaborador de Bohr, percibió que la velocidad de los electrones en el átomo de hidrógeno es una fracción considerable de la velocidad de la luz, así que había que tratarlos conforme a la teoría de la relatividad de Einstein de 1905; dio así el primer paso hacia la unión de las dos revoluciones, la teoría cuántica y la teoría de la relatividad. Cuando incluyó los efectos de la relatividad, vio que donde la teoría de Bohr predecía una órbita, la nueva teoría predecía dos muy próximas. Esto explicaba el desdoblamiento de las líneas. Al efectuar sus cálculos, Sommerfeld introdujo una «nueva abreviatura» de algunas constantes que aparecían con frecuencia en sus ecuaciones. Se trataba de 2πe² / hc, que abrevió con la letra griega alfa (α). No os preocupéis de la ecuación. Lo interesante es esto: cuando se meten los números conocidos de la carga del electrón, e, la constante de Planck, h, y la velocidad de la luz, c, sale α = 1/137. El 137, número puro.
La teoría de Bohr podía explicar una cantidad muy impresionante de datos experimentales exactos brillantemente obtenidos.
El modelo sólo tenía un problema. Que estaba equivocado.
 La teoría de retales iniciada por Niels Bohr en 1912 se iba viendo en dificultades cada vez mayores. En ésas, un estudiante de doctorado francés descubrió en 1924 una pista decisiva, que reveló en una fuente improbable, la farragosa prosa de una tesis doctoral, y que en tres años haría que se produjese una concepción de la realidad del micromundo totalmente nueva. El autor era un joven aristócrata, el príncipe Louis-Victor de Broglie, que pechaba con su doctorado en París. Le inspiró un artículo de Einstein, quien en 1909 había estado dándole vueltas al significado de los cuantos de luz. ¿Cómo era posible que la luz actuara como un enjambre de puñados de energía —es decir, como partículas— y al mismo tiempo exhibiera todos los comportamientos de las ondas, la interferencia, la difracción y otras propiedades que requerían que hubiese una longitud de onda?
La teoría de retales iniciada por Niels Bohr en 1912 se iba viendo en dificultades cada vez mayores. En ésas, un estudiante de doctorado francés descubrió en 1924 una pista decisiva, que reveló en una fuente improbable, la farragosa prosa de una tesis doctoral, y que en tres años haría que se produjese una concepción de la realidad del micromundo totalmente nueva. El autor era un joven aristócrata, el príncipe Louis-Victor de Broglie, que pechaba con su doctorado en París. Le inspiró un artículo de Einstein, quien en 1909 había estado dándole vueltas al significado de los cuantos de luz. ¿Cómo era posible que la luz actuara como un enjambre de puñados de energía —es decir, como partículas— y al mismo tiempo exhibiera todos los comportamientos de las ondas, la interferencia, la difracción y otras propiedades que requerían que hubiese una longitud de onda?
 De Broglie pensó que este curioso carácter dual de la luz podría ser una propiedad fundamental de la naturaleza y que cabría aplicarla también a objetos materiales como los electrones. En su teoría fotoeléctrica, siguiendo a Planck, Einstein había asignado una cierta energía al cuanto de luz relacionada con su longitud de onda o frecuencia. De Broglie sacó entonces a colación una simetría nueva: si las ondas pueden ser partículas, las partículas (los electrones) pueden ser ondas. Concibió un método para asignar a los electrones una longitud de onda relacionada con su energía. Su idea rindió inmediatamente frutos en cuanto se la aplicó a los electrones del átomo de hidrógeno. La asignación de una longitud de onda dio una explicación de la misteriosa regla ad hoc de Bohr según la cual al electrón sólo se le permiten ciertos radios. ¡Está claro como el agua! ¿Lo está? Seguro que sí. Si en una órbita de Bohr el electrón tiene una longitud de onda de una pizca de centímetro, sólo se permitirán aquellas en cuya circunferencia quepa un número entero de longitudes de onda.
De Broglie pensó que este curioso carácter dual de la luz podría ser una propiedad fundamental de la naturaleza y que cabría aplicarla también a objetos materiales como los electrones. En su teoría fotoeléctrica, siguiendo a Planck, Einstein había asignado una cierta energía al cuanto de luz relacionada con su longitud de onda o frecuencia. De Broglie sacó entonces a colación una simetría nueva: si las ondas pueden ser partículas, las partículas (los electrones) pueden ser ondas. Concibió un método para asignar a los electrones una longitud de onda relacionada con su energía. Su idea rindió inmediatamente frutos en cuanto se la aplicó a los electrones del átomo de hidrógeno. La asignación de una longitud de onda dio una explicación de la misteriosa regla ad hoc de Bohr según la cual al electrón sólo se le permiten ciertos radios. ¡Está claro como el agua! ¿Lo está? Seguro que sí. Si en una órbita de Bohr el electrón tiene una longitud de onda de una pizca de centímetro, sólo se permitirán aquellas en cuya circunferencia quepa un número entero de longitudes de onda.
De adolescente, Heisenberg leyó el «Timeo», donde se encuentra toda la teoría atómica de Platón. Heisenberg pensó que Platón estaba chiflado (sus «átomos» eran pequeños cubos y pirámides), pero le apasionó el supuesto básico de Platón: no se podrá entender el universo hasta que no se conozcan los componentes menores de la materia. El joven Heisenberg decidió que dedicaría su vida a estudiar las menores partículas de la materia.
Heisenberg probó con ganas hacerse una imagen mental del átomo de Rutherford-Bohr, pero no sacó nada en limpio. Las órbitas electrónicas de Bohr no se parecían a nada que pudiese imaginar. El pequeño, hermoso átomo que sería el logotipo de la Comisión de Energía Atómica durante tantos años (un núcleo circundado por órbitas con radios «mágicos» donde los electrones no radian) carecía del menor sentido. Heisenberg vio que las órbitas de Bohr no eran más que construcciones artificiales que servían para que los números saliesen bien y librarse o (mejor) burlar las objeciones clásicas al modelo atómico de Rutherford. Pero ¿eran reales esas órbitas? No. La teoría cuántica de Bohr no se había despojado hasta donde era necesario del bagaje de la física clásica. La única forma de que el espacio atómico permitiese sólo ciertas órbitas requería una proposición más radical. Heisenberg acabó por caer en la cuenta de que este nuevo átomo no era visualizable en absoluto. Concibió una guía firme: no trates de nada que no se pueda medir. Las órbitas no se podían medir. Pero las líneas espectrales sí. Heisenberg escribió una teoría llamada  «mecánica de matrices», basada en unas formas matemáticas, las matrices. Sus métodos eran difíciles matemáticamente, y aún era más difícil visualizarlos, pero estaba claro que había logrado una mejora de gran fuste de la vieja teoría de Bohr. Con el tiempo, la mecánica de matrices repitió todos los triunfos de la teoría de Bohr sin recurrir a radios mágicos arbitrarios. Y además las matrices de Heisenberg obtuvieron nuevos éxitos donde la vieja teoría había fracasado. Pero a los físicos les parecía que las matrices eran difíciles de usar.
«mecánica de matrices», basada en unas formas matemáticas, las matrices. Sus métodos eran difíciles matemáticamente, y aún era más difícil visualizarlos, pero estaba claro que había logrado una mejora de gran fuste de la vieja teoría de Bohr. Con el tiempo, la mecánica de matrices repitió todos los triunfos de la teoría de Bohr sin recurrir a radios mágicos arbitrarios. Y además las matrices de Heisenberg obtuvieron nuevos éxitos donde la vieja teoría había fracasado. Pero a los físicos les parecía que las matrices eran difíciles de usar.
Y fue entonces cuando tuvieron lugar las más famosas vacaciones de la historia de la física.
Pocos meses después de que Heisenberg hubiese completado su formulación matricial, Erwin Schrödinger decidió que necesitaba unas vacaciones. Schrödinger se había impuesto a sí mismo la misión de salvar la remendada y chirriante teoría cuántica de esa época.
Una de las cosas que Schrödinger se llevó a sus vacaciones fue el artículo de De Broglie sobre las partículas y las ondas. Trabajó febrilmente y extendió aún más la concepción cuántica. No se limitó a tratar los electrones como partículas con características ondulatorias. Enunció una ecuación en la que los electrones son ondas, ondas de materia.
Un actor clave en la famosa ecuación de Schrödinger es el símbolo griego psi, o Ψ. A los físicos les encanta decir que la ecuación lo reduce, pues, todo a suspiros, porque psi puede leerse en inglés de forma que suene como suspiro (sigh). A Ψ se le llama función de ondas, y contiene todo lo que sabemos o podamos saber sobre el electrón. Cuando se resuelve la ecuación de Schrödinger, da cómo varía Ψ en el espacio y con el tiempo. Luego se aplicó la ecuación a sistemas de muchos electrones y al final a cualquier sistema que haya que tratar cuánticamente. En otras palabras, la ecuación de Schrödinger, o la «mecánica ondulatoria», se aplica a los átomos, las moléculas, los protones, los neutrones y, lo que hoy es especialmente importante para nosotros, a los cúmulos de quarks, entre otras partículas.
 Schrödinger quería rescatar la física clásica. Insistía en que los electrones eran verdaderamente ondas clásicas, como las del sonido, las del agua o las ondas electromagnéticas maxwellianas de luz o de radio, y que su aspecto de partículas era ilusorio. Eran ondas de materia. Las ondas se conocían bien y visualizarlas era fácil, al contrario de lo que pasaba con los electrones del átomo de Bohr y sus saltos aleatorios de órbita en órbita. En la interpretación de Schrödinger, Ψ (en realidad el cuadrado de Ψ, o Ψ²) describía la distribución de esta onda de materia. Su ecuación describía esas ondas sujetas a la influencia de las fuerzas eléctricas del átomo. En el aluno de hidrógeno, por ejemplo, las ondas de Schrödinger se concentraban donde la vieja teoría de Bohr hablaba de órbitas. La ecuación daba el radio de Bohr automáticamente, sin ajustes, y proporcionaba las líneas espectrales, no sólo del hidrógeno sino también de otros elementos.
Schrödinger quería rescatar la física clásica. Insistía en que los electrones eran verdaderamente ondas clásicas, como las del sonido, las del agua o las ondas electromagnéticas maxwellianas de luz o de radio, y que su aspecto de partículas era ilusorio. Eran ondas de materia. Las ondas se conocían bien y visualizarlas era fácil, al contrario de lo que pasaba con los electrones del átomo de Bohr y sus saltos aleatorios de órbita en órbita. En la interpretación de Schrödinger, Ψ (en realidad el cuadrado de Ψ, o Ψ²) describía la distribución de esta onda de materia. Su ecuación describía esas ondas sujetas a la influencia de las fuerzas eléctricas del átomo. En el aluno de hidrógeno, por ejemplo, las ondas de Schrödinger se concentraban donde la vieja teoría de Bohr hablaba de órbitas. La ecuación daba el radio de Bohr automáticamente, sin ajustes, y proporcionaba las líneas espectrales, no sólo del hidrógeno sino también de otros elementos.
Los físicos se enamoraron de la ecuación de Schrödinger porque podían resolverla y funcionaba bien. Parecía que tanto la mecánica de matrices de Heisenberg como la ecuación de Schrödinger daban las respuestas correctas, pero la mayoría de los físicos se quedó con el método de Schrödinger porque se trataba de una ecuación diferencial de las de toda la vida, una forma cálida y familiar de matemáticas. Pocos años después se demostró que las ideas físicas y las consecuencias numéricas de las teorías de Heisenberg y Schrödinger eran idénticas. Lo único que ocurría es que estaban escritas en lenguajes matemáticos diferentes. Hoy se usa una mezcla de los aspectos más convenientes de ambas teorías.
El único problema de la ecuación de Schrödinger es que la interpretación que él le daba era errónea. Resultó que el objeto Ψ no podía representar ondas de materia. No había duda de que representaba alguna forma de onda, pero la pregunta era: ¿Qué se ondula?
 La respuesta la dio el físico alemán Max Born, en el año 1926, un año lleno de acontecimientos. Born recalcó que la única interpretación coherente de la función de onda de Schrödinger era que Ψ² representase la probabilidad de hallar la partícula, el electrón, en las diversas localizaciones. Ψ varía en el espacio y en el tiempo. Donde Ψ² es grande, es muy probable que se encuentre el electrón. Donde Ψ = 0, el electrón no se halla nunca. La función de onda es una onda de probabilidad.
La respuesta la dio el físico alemán Max Born, en el año 1926, un año lleno de acontecimientos. Born recalcó que la única interpretación coherente de la función de onda de Schrödinger era que Ψ² representase la probabilidad de hallar la partícula, el electrón, en las diversas localizaciones. Ψ varía en el espacio y en el tiempo. Donde Ψ² es grande, es muy probable que se encuentre el electrón. Donde Ψ = 0, el electrón no se halla nunca. La función de onda es una onda de probabilidad.
La interpretación de Born de la ecuación de Schrödinger es el cambio concreto más espectacular y de mayor fuste en nuestra visión del mundo desde Newton. No sorprende que a Schrödinger le pareciera la idea totalmente inaceptable y lamentase haber ideado una ecuación que daba lugar a semejante locura. Sin embargo, Bohr, Heisenberg, Sommerfeld y otros la aceptaron sin apenas protestar porque «la probabilidad se mascaba en el ambiente». El artículo de Born hacía una afirmación reveladora: la ecuación sólo puede predecir la probabilidad pero la forma matemática de ésta va por caminos perfectamente predecibles.
Demócrito lo dijo mejor cuando proclamó: «Nada hay en el universo que no sea fruto del azar y la necesidad».
El filósofo hilário y su cuchillo (I)
El filósofo hilário y su cuchillo (II)
El filósofo hilário y su cuchillo (III)
El filósofo hilário y su cuchillo (IV)
El filósofo hilário y su cuchillo (y V)
Referencia: «La partícula divina» – Leon Lederman.